Cancer statistics,2019
1
2019
... 前列腺癌(prostate cancer,PCa)是老年男性最常见的恶性肿瘤之一,也是男性癌症患者的第二大死因[1].对于晚期PCa患者,雄激素剥夺治疗(androgen-deprivation therapy,ADT)仍然是标准方法,主要通过手术或药物减少雄激素产生或干扰雄激素受体(androgen receptor,AR)功能.但大多数患者在ADT后2~3年内发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),且中位生存期14(9,30)个月;此外,CRPC患者的疾病进展风险较高,15%~33%的患者在2年内发生转移,进一步增加了这一人群的死亡负担[2]. ...
Castration-resistant prostate cancer:mechanisms,targets and treatment
1
2018
... 前列腺癌(prostate cancer,PCa)是老年男性最常见的恶性肿瘤之一,也是男性癌症患者的第二大死因[1].对于晚期PCa患者,雄激素剥夺治疗(androgen-deprivation therapy,ADT)仍然是标准方法,主要通过手术或药物减少雄激素产生或干扰雄激素受体(androgen receptor,AR)功能.但大多数患者在ADT后2~3年内发展为去势抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),且中位生存期14(9,30)个月;此外,CRPC患者的疾病进展风险较高,15%~33%的患者在2年内发生转移,进一步增加了这一人群的死亡负担[2]. ...
Recent advances on the progressive mechanism and therapy in castration-resistant prostate cancer
2
2018
... 去势治疗虽可以降低PCa患者体内雄激素水平,但多数患者在术后仍然需接受抗雄激素药物治疗,提示AR信号通路在PCa复发以及向CRPC演进中发挥了重要作用.目前研究发现,在接受ADT后的患者中AR信号通路主要通过AR过表达、雄激素局部合成、AR剪切变异体以及生长因子和细胞因子激活AR等方式被重新激活[3]. ...
... 前列腺作为雄激素依赖性器官,生长发育与AR信号通路密不可分.当AR与雄激素结合后引起AR构象改变,从热休克蛋白复合体中解离并移动到前列腺间质和腺上皮细胞核中形成二聚体,与核受体结合介导多种生物学活性,调控前列腺上皮细胞的分泌、生长、增生和凋亡.PCa的生长和演进也离不开AR信号,已有研究提示,在80%的CRPC患者中AR信号通路通过多种方式被重新激活,调节靶基因转录和PCa细胞生长[3].首先,AR与靶细胞核中特定的DNA序列结合即雄激素应答元件,招募不同的共同激活复合物,例如类固醇受体共激活子、p300/CBP相关因子、AR辅助因子等,打开染色质结构以促进转录.其次,AR通过与其他转录因子结合并向靶基因招募额外的辅激活因子来调控转录,或者招募一些辅阻遏物与雄激素应答元件结合抑制转录.最后,除了经典的AR信号,AR还可以启动核外信号,通过配体非依赖的方式被激活[5].见图1. ...
Reactive oxygen species - sources,functions,oxidative damage
1
2020
... PCa患者经过ADT后,体内会产生大量活性氧(reactive oxygen species,ROS),例如超氧阴离子(O2-)、过氧化氢(H2O2)、羟基自由基(OH-)等,破坏与抗氧化物酶之间的平衡,加重氧化应激.由于H2O2能够通过氧化催化区域的半胱氨酸残基抑制酪氨酸磷酸酶,激活酪氨酸激酶和下游信号传导,因此有学者认为H2O2可以充当第二信使,调控AR信号通路[4].本文将关于氧化应激调节AR信号传递分子机制的相关研究进行综述,对PCa临床治疗有一定意义. ...
Androgen receptor-dependent and -independent mechanisms involved in prostate cancer therapy resistance
1
2017
... 前列腺作为雄激素依赖性器官,生长发育与AR信号通路密不可分.当AR与雄激素结合后引起AR构象改变,从热休克蛋白复合体中解离并移动到前列腺间质和腺上皮细胞核中形成二聚体,与核受体结合介导多种生物学活性,调控前列腺上皮细胞的分泌、生长、增生和凋亡.PCa的生长和演进也离不开AR信号,已有研究提示,在80%的CRPC患者中AR信号通路通过多种方式被重新激活,调节靶基因转录和PCa细胞生长[3].首先,AR与靶细胞核中特定的DNA序列结合即雄激素应答元件,招募不同的共同激活复合物,例如类固醇受体共激活子、p300/CBP相关因子、AR辅助因子等,打开染色质结构以促进转录.其次,AR通过与其他转录因子结合并向靶基因招募额外的辅激活因子来调控转录,或者招募一些辅阻遏物与雄激素应答元件结合抑制转录.最后,除了经典的AR信号,AR还可以启动核外信号,通过配体非依赖的方式被激活[5].见图1. ...
Androgenic regulation of oxidative stress in the rat prostate:involvement of NAD(P)H oxidases and antioxidant defense machinery during prostatic involution and regrowth
1
2003
... 正常生理水平的雄激素能够维持前列腺中ROS与抗氧化物酶、细胞凋亡与增殖之间的平衡[6].ADT通过阻断AR信号,破坏正常雄激素状态,并提高了体内3种还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶的mRNA水平,例如Nox1、Nox2(gp91phox)和Nox4,同时也降低抗氧化物酶的表达水平,例如锰超氧化物歧化酶、硫氧还蛋白1、谷胱甘肽过氧化物酶1等,导致ROS产生过量,加重氧化应激[7]. ...
Gene polymorphisms in antioxidant enzymes correlate with the efficacy of androgen-deprivation therapy for prostate cancer with implications of oxidative stress
1
2017
... 正常生理水平的雄激素能够维持前列腺中ROS与抗氧化物酶、细胞凋亡与增殖之间的平衡[6].ADT通过阻断AR信号,破坏正常雄激素状态,并提高了体内3种还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶的mRNA水平,例如Nox1、Nox2(gp91phox)和Nox4,同时也降低抗氧化物酶的表达水平,例如锰超氧化物歧化酶、硫氧还蛋白1、谷胱甘肽过氧化物酶1等,导致ROS产生过量,加重氧化应激[7]. ...
TWIST1 homodimers and heterodimers orchestrate lineage-specific differentiation
1
2020
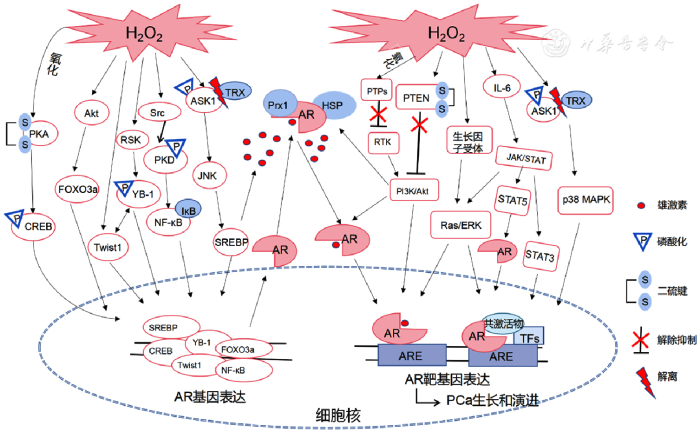
... AR过表达是基因扩增的结果,与许多转录因子的表达增加密切相关,如Twist1、Y-box结合蛋白-1(YB-1)、核因子κB(nuclear factor-kappa B,NF-κB)和cAMP应答元件结合蛋白(CREB)等,这些转录因子与AR基因启动子结合促进AR转录.H2O2通过调节Twist1二聚体向Twist1-E2a异二聚体转变诱导Twist1反式激活与表达,并与AR启动子区域的E-box序列(CANNTG)结合影响AR转录[8],见图2.在体外实验中,当PCa细胞系LNCaP细胞暴露于H2O2后会诱导Twist1表达,AR的表达也逐渐上升;然而,当LNCaP细胞暴露于H2O2和自由基清除剂N-乙酰半胱氨酸(NAC)中后,过氧化氢被完全清除,Twist1和AR基因表达也随之降低;使用Twist1特异性siRNAs沉默Twist1可以降低AR表达;这些结果提示为响应PCa细胞中的氧化应激,Twist1正调控AR表达[9,10].另外,YB-1也是一种应激相关蛋白,H2O2通过激活蛋白激酶B(PKB)/丝苏氨酸蛋白激酶(Akt)或核糖体蛋白S6激酶使YB-1在Ser102处磷酸化[11],见图2.磷酸化的YB-1核易位后与AR启动子Y-box结合,激活和调控AR转录;YB-1还可以调节AR-V7的表达,促进CRPC进展[12];YB-1也是Twist1的主要靶基因,在翻译水平影响Twist1表达,因此Twist1和YB-1之间的相互调节能够共同促进AR转录[13],见图2. ...
Interaction between docetaxel resistance and castration resistance in prostate cancer:implications of Twist1,YB-1,and androgen receptor
1
2013
... AR过表达是基因扩增的结果,与许多转录因子的表达增加密切相关,如Twist1、Y-box结合蛋白-1(YB-1)、核因子κB(nuclear factor-kappa B,NF-κB)和cAMP应答元件结合蛋白(CREB)等,这些转录因子与AR基因启动子结合促进AR转录.H2O2通过调节Twist1二聚体向Twist1-E2a异二聚体转变诱导Twist1反式激活与表达,并与AR启动子区域的E-box序列(CANNTG)结合影响AR转录[8],见图2.在体外实验中,当PCa细胞系LNCaP细胞暴露于H2O2后会诱导Twist1表达,AR的表达也逐渐上升;然而,当LNCaP细胞暴露于H2O2和自由基清除剂N-乙酰半胱氨酸(NAC)中后,过氧化氢被完全清除,Twist1和AR基因表达也随之降低;使用Twist1特异性siRNAs沉默Twist1可以降低AR表达;这些结果提示为响应PCa细胞中的氧化应激,Twist1正调控AR表达[9,10].另外,YB-1也是一种应激相关蛋白,H2O2通过激活蛋白激酶B(PKB)/丝苏氨酸蛋白激酶(Akt)或核糖体蛋白S6激酶使YB-1在Ser102处磷酸化[11],见图2.磷酸化的YB-1核易位后与AR启动子Y-box结合,激活和调控AR转录;YB-1还可以调节AR-V7的表达,促进CRPC进展[12];YB-1也是Twist1的主要靶基因,在翻译水平影响Twist1表达,因此Twist1和YB-1之间的相互调节能够共同促进AR转录[13],见图2. ...
PLCε regulates prostate cancer mitochondrial oxidative metabolism and migration via upregulation of Twist1
1
2019
... AR过表达是基因扩增的结果,与许多转录因子的表达增加密切相关,如Twist1、Y-box结合蛋白-1(YB-1)、核因子κB(nuclear factor-kappa B,NF-κB)和cAMP应答元件结合蛋白(CREB)等,这些转录因子与AR基因启动子结合促进AR转录.H2O2通过调节Twist1二聚体向Twist1-E2a异二聚体转变诱导Twist1反式激活与表达,并与AR启动子区域的E-box序列(CANNTG)结合影响AR转录[8],见图2.在体外实验中,当PCa细胞系LNCaP细胞暴露于H2O2后会诱导Twist1表达,AR的表达也逐渐上升;然而,当LNCaP细胞暴露于H2O2和自由基清除剂N-乙酰半胱氨酸(NAC)中后,过氧化氢被完全清除,Twist1和AR基因表达也随之降低;使用Twist1特异性siRNAs沉默Twist1可以降低AR表达;这些结果提示为响应PCa细胞中的氧化应激,Twist1正调控AR表达[9,10].另外,YB-1也是一种应激相关蛋白,H2O2通过激活蛋白激酶B(PKB)/丝苏氨酸蛋白激酶(Akt)或核糖体蛋白S6激酶使YB-1在Ser102处磷酸化[11],见图2.磷酸化的YB-1核易位后与AR启动子Y-box结合,激活和调控AR转录;YB-1还可以调节AR-V7的表达,促进CRPC进展[12];YB-1也是Twist1的主要靶基因,在翻译水平影响Twist1表达,因此Twist1和YB-1之间的相互调节能够共同促进AR转录[13],见图2. ...
YB-1 protein:functions and regulation
1
2014
... AR过表达是基因扩增的结果,与许多转录因子的表达增加密切相关,如Twist1、Y-box结合蛋白-1(YB-1)、核因子κB(nuclear factor-kappa B,NF-κB)和cAMP应答元件结合蛋白(CREB)等,这些转录因子与AR基因启动子结合促进AR转录.H2O2通过调节Twist1二聚体向Twist1-E2a异二聚体转变诱导Twist1反式激活与表达,并与AR启动子区域的E-box序列(CANNTG)结合影响AR转录[8],见图2.在体外实验中,当PCa细胞系LNCaP细胞暴露于H2O2后会诱导Twist1表达,AR的表达也逐渐上升;然而,当LNCaP细胞暴露于H2O2和自由基清除剂N-乙酰半胱氨酸(NAC)中后,过氧化氢被完全清除,Twist1和AR基因表达也随之降低;使用Twist1特异性siRNAs沉默Twist1可以降低AR表达;这些结果提示为响应PCa细胞中的氧化应激,Twist1正调控AR表达[9,10].另外,YB-1也是一种应激相关蛋白,H2O2通过激活蛋白激酶B(PKB)/丝苏氨酸蛋白激酶(Akt)或核糖体蛋白S6激酶使YB-1在Ser102处磷酸化[11],见图2.磷酸化的YB-1核易位后与AR启动子Y-box结合,激活和调控AR转录;YB-1还可以调节AR-V7的表达,促进CRPC进展[12];YB-1也是Twist1的主要靶基因,在翻译水平影响Twist1表达,因此Twist1和YB-1之间的相互调节能够共同促进AR转录[13],见图2. ...
Gene amplification of YB-1 in castration-resistant prostate cancer in association with aberrant androgen receptor expression
1
2021
... AR过表达是基因扩增的结果,与许多转录因子的表达增加密切相关,如Twist1、Y-box结合蛋白-1(YB-1)、核因子κB(nuclear factor-kappa B,NF-κB)和cAMP应答元件结合蛋白(CREB)等,这些转录因子与AR基因启动子结合促进AR转录.H2O2通过调节Twist1二聚体向Twist1-E2a异二聚体转变诱导Twist1反式激活与表达,并与AR启动子区域的E-box序列(CANNTG)结合影响AR转录[8],见图2.在体外实验中,当PCa细胞系LNCaP细胞暴露于H2O2后会诱导Twist1表达,AR的表达也逐渐上升;然而,当LNCaP细胞暴露于H2O2和自由基清除剂N-乙酰半胱氨酸(NAC)中后,过氧化氢被完全清除,Twist1和AR基因表达也随之降低;使用Twist1特异性siRNAs沉默Twist1可以降低AR表达;这些结果提示为响应PCa细胞中的氧化应激,Twist1正调控AR表达[9,10].另外,YB-1也是一种应激相关蛋白,H2O2通过激活蛋白激酶B(PKB)/丝苏氨酸蛋白激酶(Akt)或核糖体蛋白S6激酶使YB-1在Ser102处磷酸化[11],见图2.磷酸化的YB-1核易位后与AR启动子Y-box结合,激活和调控AR转录;YB-1还可以调节AR-V7的表达,促进CRPC进展[12];YB-1也是Twist1的主要靶基因,在翻译水平影响Twist1表达,因此Twist1和YB-1之间的相互调节能够共同促进AR转录[13],见图2. ...
Translational activation of snail1 and other developmentally regulated transcription factors by YB-1 promotes an epithelial-mesenchymal transition
1
2009
... AR过表达是基因扩增的结果,与许多转录因子的表达增加密切相关,如Twist1、Y-box结合蛋白-1(YB-1)、核因子κB(nuclear factor-kappa B,NF-κB)和cAMP应答元件结合蛋白(CREB)等,这些转录因子与AR基因启动子结合促进AR转录.H2O2通过调节Twist1二聚体向Twist1-E2a异二聚体转变诱导Twist1反式激活与表达,并与AR启动子区域的E-box序列(CANNTG)结合影响AR转录[8],见图2.在体外实验中,当PCa细胞系LNCaP细胞暴露于H2O2后会诱导Twist1表达,AR的表达也逐渐上升;然而,当LNCaP细胞暴露于H2O2和自由基清除剂N-乙酰半胱氨酸(NAC)中后,过氧化氢被完全清除,Twist1和AR基因表达也随之降低;使用Twist1特异性siRNAs沉默Twist1可以降低AR表达;这些结果提示为响应PCa细胞中的氧化应激,Twist1正调控AR表达[9,10].另外,YB-1也是一种应激相关蛋白,H2O2通过激活蛋白激酶B(PKB)/丝苏氨酸蛋白激酶(Akt)或核糖体蛋白S6激酶使YB-1在Ser102处磷酸化[11],见图2.磷酸化的YB-1核易位后与AR启动子Y-box结合,激活和调控AR转录;YB-1还可以调节AR-V7的表达,促进CRPC进展[12];YB-1也是Twist1的主要靶基因,在翻译水平影响Twist1表达,因此Twist1和YB-1之间的相互调节能够共同促进AR转录[13],见图2. ...
Crosstalk between androgen and pro-inflammatory signaling remodels androgen receptor and NF-κB cistrome to reprogram the prostate cancer cell transcriptome
1
2017
... 雄激素和NF-κB信号通路之间的相互作用可以改变AR转录活性,重新编码PCa细胞的转录组,从而影响PCa向CRPC的转化[14].NF-κB二聚体在细胞质中与核因子-κB抑制蛋白(IκB)形成复合物被隔离,H2O2通过蛋白激酶D(PKD)激活IκB激酶(IKK)复合物,IKK激活后使NF-κB与IκB解离并向细胞核易位,在此过程中H2O2通过Src介导的两条信号通路激活PKD.活化的Src首先通过Abl诱导PKD在PH(pleckstrin homology)结构域Y463处磷酸化,使PH结构域暴露;其次,在PKD的催化结构域和活化环残基S738/S742上被PKCδ第二次磷酸化,导致PKD完全激活.IKK被PKD激活后导致IκBα蛋白在Ser32和Ser36处磷酸化,随后被降解,NF-κB二聚体从复合物中解离并易位到细胞核[15],见图2.NF-κB进入细胞核后直接与AR启动子和增强子结合,调节AR的表达和功能,并提高血清前列腺特异性抗原(PSA)水平以及细胞增殖水平[16].NF-κB还可以促进剪接因子核内不均一核糖核蛋白A1(hnRNPA1)生成,诱导AR产生剪接变异体,如AR-V7对ADT产生抗性[17].除了直接调节AR外,NF-κB还可以通过促进Twist1的表达间接影响AR转录活性.由ROS介导的其他肿瘤相关信号通路中,NF-κB作为许多信号下游底物中的重要底物在前列腺肿瘤的增殖中发挥重要作用,例如丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶(PI3K)、PKB和蛋白激酶C(PKC)[18,19].因此,ADT的同时阻断NF-κB信号可能是降低CRPC细胞生长的有效策略. ...
NF-kappaB activation by reactive oxygen species:fifteen years later
1
2006
... 雄激素和NF-κB信号通路之间的相互作用可以改变AR转录活性,重新编码PCa细胞的转录组,从而影响PCa向CRPC的转化[14].NF-κB二聚体在细胞质中与核因子-κB抑制蛋白(IκB)形成复合物被隔离,H2O2通过蛋白激酶D(PKD)激活IκB激酶(IKK)复合物,IKK激活后使NF-κB与IκB解离并向细胞核易位,在此过程中H2O2通过Src介导的两条信号通路激活PKD.活化的Src首先通过Abl诱导PKD在PH(pleckstrin homology)结构域Y463处磷酸化,使PH结构域暴露;其次,在PKD的催化结构域和活化环残基S738/S742上被PKCδ第二次磷酸化,导致PKD完全激活.IKK被PKD激活后导致IκBα蛋白在Ser32和Ser36处磷酸化,随后被降解,NF-κB二聚体从复合物中解离并易位到细胞核[15],见图2.NF-κB进入细胞核后直接与AR启动子和增强子结合,调节AR的表达和功能,并提高血清前列腺特异性抗原(PSA)水平以及细胞增殖水平[16].NF-κB还可以促进剪接因子核内不均一核糖核蛋白A1(hnRNPA1)生成,诱导AR产生剪接变异体,如AR-V7对ADT产生抗性[17].除了直接调节AR外,NF-κB还可以通过促进Twist1的表达间接影响AR转录活性.由ROS介导的其他肿瘤相关信号通路中,NF-κB作为许多信号下游底物中的重要底物在前列腺肿瘤的增殖中发挥重要作用,例如丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶(PI3K)、PKB和蛋白激酶C(PKC)[18,19].因此,ADT的同时阻断NF-κB信号可能是降低CRPC细胞生长的有效策略. ...
NF-κB signaling promotes castration-resistant prostate cancer initiation and progression
1
2020
... 雄激素和NF-κB信号通路之间的相互作用可以改变AR转录活性,重新编码PCa细胞的转录组,从而影响PCa向CRPC的转化[14].NF-κB二聚体在细胞质中与核因子-κB抑制蛋白(IκB)形成复合物被隔离,H2O2通过蛋白激酶D(PKD)激活IκB激酶(IKK)复合物,IKK激活后使NF-κB与IκB解离并向细胞核易位,在此过程中H2O2通过Src介导的两条信号通路激活PKD.活化的Src首先通过Abl诱导PKD在PH(pleckstrin homology)结构域Y463处磷酸化,使PH结构域暴露;其次,在PKD的催化结构域和活化环残基S738/S742上被PKCδ第二次磷酸化,导致PKD完全激活.IKK被PKD激活后导致IκBα蛋白在Ser32和Ser36处磷酸化,随后被降解,NF-κB二聚体从复合物中解离并易位到细胞核[15],见图2.NF-κB进入细胞核后直接与AR启动子和增强子结合,调节AR的表达和功能,并提高血清前列腺特异性抗原(PSA)水平以及细胞增殖水平[16].NF-κB还可以促进剪接因子核内不均一核糖核蛋白A1(hnRNPA1)生成,诱导AR产生剪接变异体,如AR-V7对ADT产生抗性[17].除了直接调节AR外,NF-κB还可以通过促进Twist1的表达间接影响AR转录活性.由ROS介导的其他肿瘤相关信号通路中,NF-κB作为许多信号下游底物中的重要底物在前列腺肿瘤的增殖中发挥重要作用,例如丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶(PI3K)、PKB和蛋白激酶C(PKC)[18,19].因此,ADT的同时阻断NF-κB信号可能是降低CRPC细胞生长的有效策略. ...
NF-κB2/p52:c-myc:hnRNPA1 pathway regulates expression of androgen receptor splice variants and enzalutamide sensitivity in prostate cancer
1
2015
... 雄激素和NF-κB信号通路之间的相互作用可以改变AR转录活性,重新编码PCa细胞的转录组,从而影响PCa向CRPC的转化[14].NF-κB二聚体在细胞质中与核因子-κB抑制蛋白(IκB)形成复合物被隔离,H2O2通过蛋白激酶D(PKD)激活IκB激酶(IKK)复合物,IKK激活后使NF-κB与IκB解离并向细胞核易位,在此过程中H2O2通过Src介导的两条信号通路激活PKD.活化的Src首先通过Abl诱导PKD在PH(pleckstrin homology)结构域Y463处磷酸化,使PH结构域暴露;其次,在PKD的催化结构域和活化环残基S738/S742上被PKCδ第二次磷酸化,导致PKD完全激活.IKK被PKD激活后导致IκBα蛋白在Ser32和Ser36处磷酸化,随后被降解,NF-κB二聚体从复合物中解离并易位到细胞核[15],见图2.NF-κB进入细胞核后直接与AR启动子和增强子结合,调节AR的表达和功能,并提高血清前列腺特异性抗原(PSA)水平以及细胞增殖水平[16].NF-κB还可以促进剪接因子核内不均一核糖核蛋白A1(hnRNPA1)生成,诱导AR产生剪接变异体,如AR-V7对ADT产生抗性[17].除了直接调节AR外,NF-κB还可以通过促进Twist1的表达间接影响AR转录活性.由ROS介导的其他肿瘤相关信号通路中,NF-κB作为许多信号下游底物中的重要底物在前列腺肿瘤的增殖中发挥重要作用,例如丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶(PI3K)、PKB和蛋白激酶C(PKC)[18,19].因此,ADT的同时阻断NF-κB信号可能是降低CRPC细胞生长的有效策略. ...
Protein kinase C regulates Twist1 expression via NF-κB in prostate cancer
1
2017
... 雄激素和NF-κB信号通路之间的相互作用可以改变AR转录活性,重新编码PCa细胞的转录组,从而影响PCa向CRPC的转化[14].NF-κB二聚体在细胞质中与核因子-κB抑制蛋白(IκB)形成复合物被隔离,H2O2通过蛋白激酶D(PKD)激活IκB激酶(IKK)复合物,IKK激活后使NF-κB与IκB解离并向细胞核易位,在此过程中H2O2通过Src介导的两条信号通路激活PKD.活化的Src首先通过Abl诱导PKD在PH(pleckstrin homology)结构域Y463处磷酸化,使PH结构域暴露;其次,在PKD的催化结构域和活化环残基S738/S742上被PKCδ第二次磷酸化,导致PKD完全激活.IKK被PKD激活后导致IκBα蛋白在Ser32和Ser36处磷酸化,随后被降解,NF-κB二聚体从复合物中解离并易位到细胞核[15],见图2.NF-κB进入细胞核后直接与AR启动子和增强子结合,调节AR的表达和功能,并提高血清前列腺特异性抗原(PSA)水平以及细胞增殖水平[16].NF-κB还可以促进剪接因子核内不均一核糖核蛋白A1(hnRNPA1)生成,诱导AR产生剪接变异体,如AR-V7对ADT产生抗性[17].除了直接调节AR外,NF-κB还可以通过促进Twist1的表达间接影响AR转录活性.由ROS介导的其他肿瘤相关信号通路中,NF-κB作为许多信号下游底物中的重要底物在前列腺肿瘤的增殖中发挥重要作用,例如丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶(PI3K)、PKB和蛋白激酶C(PKC)[18,19].因此,ADT的同时阻断NF-κB信号可能是降低CRPC细胞生长的有效策略. ...
Visfatin promotes monocyte adhesion by upregulating ICAM-1 and VCAM-1 expression in endothelial cells via activation of p38-PI3K-Akt signaling and subsequent ROS production and IKK/NF-κB activation
1
2019
... 雄激素和NF-κB信号通路之间的相互作用可以改变AR转录活性,重新编码PCa细胞的转录组,从而影响PCa向CRPC的转化[14].NF-κB二聚体在细胞质中与核因子-κB抑制蛋白(IκB)形成复合物被隔离,H2O2通过蛋白激酶D(PKD)激活IκB激酶(IKK)复合物,IKK激活后使NF-κB与IκB解离并向细胞核易位,在此过程中H2O2通过Src介导的两条信号通路激活PKD.活化的Src首先通过Abl诱导PKD在PH(pleckstrin homology)结构域Y463处磷酸化,使PH结构域暴露;其次,在PKD的催化结构域和活化环残基S738/S742上被PKCδ第二次磷酸化,导致PKD完全激活.IKK被PKD激活后导致IκBα蛋白在Ser32和Ser36处磷酸化,随后被降解,NF-κB二聚体从复合物中解离并易位到细胞核[15],见图2.NF-κB进入细胞核后直接与AR启动子和增强子结合,调节AR的表达和功能,并提高血清前列腺特异性抗原(PSA)水平以及细胞增殖水平[16].NF-κB还可以促进剪接因子核内不均一核糖核蛋白A1(hnRNPA1)生成,诱导AR产生剪接变异体,如AR-V7对ADT产生抗性[17].除了直接调节AR外,NF-κB还可以通过促进Twist1的表达间接影响AR转录活性.由ROS介导的其他肿瘤相关信号通路中,NF-κB作为许多信号下游底物中的重要底物在前列腺肿瘤的增殖中发挥重要作用,例如丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇3-激酶(PI3K)、PKB和蛋白激酶C(PKC)[18,19].因此,ADT的同时阻断NF-κB信号可能是降低CRPC细胞生长的有效策略. ...
Protein kinase A-mediated CREB phosphorylation is an oxidant-induced survival pathway in alveolar type II cells
1
2008
... CREB是一种与cAMP反应元件(CRE)结合的转录因子,参与调控AR的转录.ROS氧化蛋白激酶A(PKA)Ⅰ型调节亚基的Cys17和Cys38,使PKA亚基间形成二硫键,导致全酶复合物解离并激活[20],见图2.CREB被PKA磷酸化后与AR基因启动子区的cAMP反应元件结合,调控AR转录.此外,去势治疗通过抑制超氧化物歧化酶2的表达,以依赖ROS的方式调控5种核受体共调节因子的表达,包括核受体共激活因子4(NCOA4),并通过改变共调节因子之间的平衡诱导AR重新激活[21]. ...
Reactive oxygen species,aging and articular cartilage homeostasis
1
2019
... CREB是一种与cAMP反应元件(CRE)结合的转录因子,参与调控AR的转录.ROS氧化蛋白激酶A(PKA)Ⅰ型调节亚基的Cys17和Cys38,使PKA亚基间形成二硫键,导致全酶复合物解离并激活[20],见图2.CREB被PKA磷酸化后与AR基因启动子区的cAMP反应元件结合,调控AR转录.此外,去势治疗通过抑制超氧化物歧化酶2的表达,以依赖ROS的方式调控5种核受体共调节因子的表达,包括核受体共激活因子4(NCOA4),并通过改变共调节因子之间的平衡诱导AR重新激活[21]. ...
The impact of genetic variants on pten molecular functions and cellular phenotypes
1
2019
... 氧化应激还可以通过肿瘤信号通路激活与AR表达相关的转录因子.在PI3K/Akt信号通路中,ROS通过抑制同源性磷酸酶-张力蛋白(PTEN)来提高PI3K/Akt信号的活性[22].首先,H2O2介导PTEN上的半胱氨酸残基Cys-124和Cys-71之间形成二硫键使PTEN失去活性,从而增强其稳定性并阻止其向膜募集,见图2.其次,H2O2还可以诱导PTEN的翻译后修饰,例如S-亚硝基化(SNO),其有助于增强泛素蛋白酶体功能,导致PTEN失活和降解.PTEN的失活不仅减轻了对Akt信号通路的抑制,而且也使抑制PCa细胞增殖的NKX3.1基因表达明显降低[23].Akt被氧化应激激活后热休克蛋白27活性也随之增强,不仅可以防止AR降解,且可通过十六烷酰化修饰AR,促进AR核定位[24,25],见图2.叉头框蛋白O亚族3a(FOXO3a)作为Akt下游的靶基因,与AR启动子区域的FOXO反应元件结合促进AR转录,可以推动CRPC的演进[26].在MAPK信号通路中,凋亡信号调节激酶(apoptosissignal regulatingkinase 1,ASK1)是上游MAPKKK中的一种,使MKK4、MKK3和MKK6磷酸化并调节JNK和p38MAPK通路.ASK1以硫氧还蛋白(TRX)-ASK复合物的形式被ROS激活[27].TRX是一种氧化还原调节蛋白,具有感应ROS水平和维持细胞内氧化还原状态以及调节ASK1活性的作用.在休眠细胞中,还原形式的TRX与ASK1的N端结构域结合,并通过其N端螺旋结构域干扰活性同源寡聚体的形成,从而使ASK1保持非活性状态.H2O2产生后,TRX转变成氧化形式并从ASK1中解离,触发ASK1自磷酸化且获得激酶活性[28],见图2.JNK信号通路被激活后触发了下游靶基因的转录,如甾醇调节元件结合蛋白(SREBP),见图2.在LNCaP细胞中SREBP-1可以与AR启动子结合影响AR转录促进PCa细胞增殖,同时通过诱导Nox5表达,提高ROS水平[29]. ...
Loss of PTEN accelerates NKX3.1 degradation to promote prostate cancer progression
1
2019
... 氧化应激还可以通过肿瘤信号通路激活与AR表达相关的转录因子.在PI3K/Akt信号通路中,ROS通过抑制同源性磷酸酶-张力蛋白(PTEN)来提高PI3K/Akt信号的活性[22].首先,H2O2介导PTEN上的半胱氨酸残基Cys-124和Cys-71之间形成二硫键使PTEN失去活性,从而增强其稳定性并阻止其向膜募集,见图2.其次,H2O2还可以诱导PTEN的翻译后修饰,例如S-亚硝基化(SNO),其有助于增强泛素蛋白酶体功能,导致PTEN失活和降解.PTEN的失活不仅减轻了对Akt信号通路的抑制,而且也使抑制PCa细胞增殖的NKX3.1基因表达明显降低[23].Akt被氧化应激激活后热休克蛋白27活性也随之增强,不仅可以防止AR降解,且可通过十六烷酰化修饰AR,促进AR核定位[24,25],见图2.叉头框蛋白O亚族3a(FOXO3a)作为Akt下游的靶基因,与AR启动子区域的FOXO反应元件结合促进AR转录,可以推动CRPC的演进[26].在MAPK信号通路中,凋亡信号调节激酶(apoptosissignal regulatingkinase 1,ASK1)是上游MAPKKK中的一种,使MKK4、MKK3和MKK6磷酸化并调节JNK和p38MAPK通路.ASK1以硫氧还蛋白(TRX)-ASK复合物的形式被ROS激活[27].TRX是一种氧化还原调节蛋白,具有感应ROS水平和维持细胞内氧化还原状态以及调节ASK1活性的作用.在休眠细胞中,还原形式的TRX与ASK1的N端结构域结合,并通过其N端螺旋结构域干扰活性同源寡聚体的形成,从而使ASK1保持非活性状态.H2O2产生后,TRX转变成氧化形式并从ASK1中解离,触发ASK1自磷酸化且获得激酶活性[28],见图2.JNK信号通路被激活后触发了下游靶基因的转录,如甾醇调节元件结合蛋白(SREBP),见图2.在LNCaP细胞中SREBP-1可以与AR启动子结合影响AR转录促进PCa细胞增殖,同时通过诱导Nox5表达,提高ROS水平[29]. ...
Membrane-associated androgen receptor(AR)potentiates its transcriptional activities by activating heat shock protein 27(HSP27)
1
2018
... 氧化应激还可以通过肿瘤信号通路激活与AR表达相关的转录因子.在PI3K/Akt信号通路中,ROS通过抑制同源性磷酸酶-张力蛋白(PTEN)来提高PI3K/Akt信号的活性[22].首先,H2O2介导PTEN上的半胱氨酸残基Cys-124和Cys-71之间形成二硫键使PTEN失去活性,从而增强其稳定性并阻止其向膜募集,见图2.其次,H2O2还可以诱导PTEN的翻译后修饰,例如S-亚硝基化(SNO),其有助于增强泛素蛋白酶体功能,导致PTEN失活和降解.PTEN的失活不仅减轻了对Akt信号通路的抑制,而且也使抑制PCa细胞增殖的NKX3.1基因表达明显降低[23].Akt被氧化应激激活后热休克蛋白27活性也随之增强,不仅可以防止AR降解,且可通过十六烷酰化修饰AR,促进AR核定位[24,25],见图2.叉头框蛋白O亚族3a(FOXO3a)作为Akt下游的靶基因,与AR启动子区域的FOXO反应元件结合促进AR转录,可以推动CRPC的演进[26].在MAPK信号通路中,凋亡信号调节激酶(apoptosissignal regulatingkinase 1,ASK1)是上游MAPKKK中的一种,使MKK4、MKK3和MKK6磷酸化并调节JNK和p38MAPK通路.ASK1以硫氧还蛋白(TRX)-ASK复合物的形式被ROS激活[27].TRX是一种氧化还原调节蛋白,具有感应ROS水平和维持细胞内氧化还原状态以及调节ASK1活性的作用.在休眠细胞中,还原形式的TRX与ASK1的N端结构域结合,并通过其N端螺旋结构域干扰活性同源寡聚体的形成,从而使ASK1保持非活性状态.H2O2产生后,TRX转变成氧化形式并从ASK1中解离,触发ASK1自磷酸化且获得激酶活性[28],见图2.JNK信号通路被激活后触发了下游靶基因的转录,如甾醇调节元件结合蛋白(SREBP),见图2.在LNCaP细胞中SREBP-1可以与AR启动子结合影响AR转录促进PCa细胞增殖,同时通过诱导Nox5表达,提高ROS水平[29]. ...
Melanoma migration is promoted by prion protein via Akt-hsp27 signaling axis
1
2020
... 氧化应激还可以通过肿瘤信号通路激活与AR表达相关的转录因子.在PI3K/Akt信号通路中,ROS通过抑制同源性磷酸酶-张力蛋白(PTEN)来提高PI3K/Akt信号的活性[22].首先,H2O2介导PTEN上的半胱氨酸残基Cys-124和Cys-71之间形成二硫键使PTEN失去活性,从而增强其稳定性并阻止其向膜募集,见图2.其次,H2O2还可以诱导PTEN的翻译后修饰,例如S-亚硝基化(SNO),其有助于增强泛素蛋白酶体功能,导致PTEN失活和降解.PTEN的失活不仅减轻了对Akt信号通路的抑制,而且也使抑制PCa细胞增殖的NKX3.1基因表达明显降低[23].Akt被氧化应激激活后热休克蛋白27活性也随之增强,不仅可以防止AR降解,且可通过十六烷酰化修饰AR,促进AR核定位[24,25],见图2.叉头框蛋白O亚族3a(FOXO3a)作为Akt下游的靶基因,与AR启动子区域的FOXO反应元件结合促进AR转录,可以推动CRPC的演进[26].在MAPK信号通路中,凋亡信号调节激酶(apoptosissignal regulatingkinase 1,ASK1)是上游MAPKKK中的一种,使MKK4、MKK3和MKK6磷酸化并调节JNK和p38MAPK通路.ASK1以硫氧还蛋白(TRX)-ASK复合物的形式被ROS激活[27].TRX是一种氧化还原调节蛋白,具有感应ROS水平和维持细胞内氧化还原状态以及调节ASK1活性的作用.在休眠细胞中,还原形式的TRX与ASK1的N端结构域结合,并通过其N端螺旋结构域干扰活性同源寡聚体的形成,从而使ASK1保持非活性状态.H2O2产生后,TRX转变成氧化形式并从ASK1中解离,触发ASK1自磷酸化且获得激酶活性[28],见图2.JNK信号通路被激活后触发了下游靶基因的转录,如甾醇调节元件结合蛋白(SREBP),见图2.在LNCaP细胞中SREBP-1可以与AR启动子结合影响AR转录促进PCa细胞增殖,同时通过诱导Nox5表达,提高ROS水平[29]. ...
Induction of androgen receptor expression by phosphatidylinositol 3-kinase/Akt downstream substrate,FOXO3a,and their roles in apoptosis of LNCaP prostate cancer cells
1
2005
... 氧化应激还可以通过肿瘤信号通路激活与AR表达相关的转录因子.在PI3K/Akt信号通路中,ROS通过抑制同源性磷酸酶-张力蛋白(PTEN)来提高PI3K/Akt信号的活性[22].首先,H2O2介导PTEN上的半胱氨酸残基Cys-124和Cys-71之间形成二硫键使PTEN失去活性,从而增强其稳定性并阻止其向膜募集,见图2.其次,H2O2还可以诱导PTEN的翻译后修饰,例如S-亚硝基化(SNO),其有助于增强泛素蛋白酶体功能,导致PTEN失活和降解.PTEN的失活不仅减轻了对Akt信号通路的抑制,而且也使抑制PCa细胞增殖的NKX3.1基因表达明显降低[23].Akt被氧化应激激活后热休克蛋白27活性也随之增强,不仅可以防止AR降解,且可通过十六烷酰化修饰AR,促进AR核定位[24,25],见图2.叉头框蛋白O亚族3a(FOXO3a)作为Akt下游的靶基因,与AR启动子区域的FOXO反应元件结合促进AR转录,可以推动CRPC的演进[26].在MAPK信号通路中,凋亡信号调节激酶(apoptosissignal regulatingkinase 1,ASK1)是上游MAPKKK中的一种,使MKK4、MKK3和MKK6磷酸化并调节JNK和p38MAPK通路.ASK1以硫氧还蛋白(TRX)-ASK复合物的形式被ROS激活[27].TRX是一种氧化还原调节蛋白,具有感应ROS水平和维持细胞内氧化还原状态以及调节ASK1活性的作用.在休眠细胞中,还原形式的TRX与ASK1的N端结构域结合,并通过其N端螺旋结构域干扰活性同源寡聚体的形成,从而使ASK1保持非活性状态.H2O2产生后,TRX转变成氧化形式并从ASK1中解离,触发ASK1自磷酸化且获得激酶活性[28],见图2.JNK信号通路被激活后触发了下游靶基因的转录,如甾醇调节元件结合蛋白(SREBP),见图2.在LNCaP细胞中SREBP-1可以与AR启动子结合影响AR转录促进PCa细胞增殖,同时通过诱导Nox5表达,提高ROS水平[29]. ...
Structural aspects of protein kinase ASK1 regulation
1
2017
... 氧化应激还可以通过肿瘤信号通路激活与AR表达相关的转录因子.在PI3K/Akt信号通路中,ROS通过抑制同源性磷酸酶-张力蛋白(PTEN)来提高PI3K/Akt信号的活性[22].首先,H2O2介导PTEN上的半胱氨酸残基Cys-124和Cys-71之间形成二硫键使PTEN失去活性,从而增强其稳定性并阻止其向膜募集,见图2.其次,H2O2还可以诱导PTEN的翻译后修饰,例如S-亚硝基化(SNO),其有助于增强泛素蛋白酶体功能,导致PTEN失活和降解.PTEN的失活不仅减轻了对Akt信号通路的抑制,而且也使抑制PCa细胞增殖的NKX3.1基因表达明显降低[23].Akt被氧化应激激活后热休克蛋白27活性也随之增强,不仅可以防止AR降解,且可通过十六烷酰化修饰AR,促进AR核定位[24,25],见图2.叉头框蛋白O亚族3a(FOXO3a)作为Akt下游的靶基因,与AR启动子区域的FOXO反应元件结合促进AR转录,可以推动CRPC的演进[26].在MAPK信号通路中,凋亡信号调节激酶(apoptosissignal regulatingkinase 1,ASK1)是上游MAPKKK中的一种,使MKK4、MKK3和MKK6磷酸化并调节JNK和p38MAPK通路.ASK1以硫氧还蛋白(TRX)-ASK复合物的形式被ROS激活[27].TRX是一种氧化还原调节蛋白,具有感应ROS水平和维持细胞内氧化还原状态以及调节ASK1活性的作用.在休眠细胞中,还原形式的TRX与ASK1的N端结构域结合,并通过其N端螺旋结构域干扰活性同源寡聚体的形成,从而使ASK1保持非活性状态.H2O2产生后,TRX转变成氧化形式并从ASK1中解离,触发ASK1自磷酸化且获得激酶活性[28],见图2.JNK信号通路被激活后触发了下游靶基因的转录,如甾醇调节元件结合蛋白(SREBP),见图2.在LNCaP细胞中SREBP-1可以与AR启动子结合影响AR转录促进PCa细胞增殖,同时通过诱导Nox5表达,提高ROS水平[29]. ...
Thioredoxin-ASK1 complex levels regulate ROS-mediated p38 MAPK pathway activity in livers of aged and long-lived Snell dwarf mice
1
2006
... 氧化应激还可以通过肿瘤信号通路激活与AR表达相关的转录因子.在PI3K/Akt信号通路中,ROS通过抑制同源性磷酸酶-张力蛋白(PTEN)来提高PI3K/Akt信号的活性[22].首先,H2O2介导PTEN上的半胱氨酸残基Cys-124和Cys-71之间形成二硫键使PTEN失去活性,从而增强其稳定性并阻止其向膜募集,见图2.其次,H2O2还可以诱导PTEN的翻译后修饰,例如S-亚硝基化(SNO),其有助于增强泛素蛋白酶体功能,导致PTEN失活和降解.PTEN的失活不仅减轻了对Akt信号通路的抑制,而且也使抑制PCa细胞增殖的NKX3.1基因表达明显降低[23].Akt被氧化应激激活后热休克蛋白27活性也随之增强,不仅可以防止AR降解,且可通过十六烷酰化修饰AR,促进AR核定位[24,25],见图2.叉头框蛋白O亚族3a(FOXO3a)作为Akt下游的靶基因,与AR启动子区域的FOXO反应元件结合促进AR转录,可以推动CRPC的演进[26].在MAPK信号通路中,凋亡信号调节激酶(apoptosissignal regulatingkinase 1,ASK1)是上游MAPKKK中的一种,使MKK4、MKK3和MKK6磷酸化并调节JNK和p38MAPK通路.ASK1以硫氧还蛋白(TRX)-ASK复合物的形式被ROS激活[27].TRX是一种氧化还原调节蛋白,具有感应ROS水平和维持细胞内氧化还原状态以及调节ASK1活性的作用.在休眠细胞中,还原形式的TRX与ASK1的N端结构域结合,并通过其N端螺旋结构域干扰活性同源寡聚体的形成,从而使ASK1保持非活性状态.H2O2产生后,TRX转变成氧化形式并从ASK1中解离,触发ASK1自磷酸化且获得激酶活性[28],见图2.JNK信号通路被激活后触发了下游靶基因的转录,如甾醇调节元件结合蛋白(SREBP),见图2.在LNCaP细胞中SREBP-1可以与AR启动子结合影响AR转录促进PCa细胞增殖,同时通过诱导Nox5表达,提高ROS水平[29]. ...
Activation of androgen receptor,lipogenesis,and oxidative stress converged by SREBP-1 is responsible for regulating growth and progression of prostate cancer cells
1
2012
... 氧化应激还可以通过肿瘤信号通路激活与AR表达相关的转录因子.在PI3K/Akt信号通路中,ROS通过抑制同源性磷酸酶-张力蛋白(PTEN)来提高PI3K/Akt信号的活性[22].首先,H2O2介导PTEN上的半胱氨酸残基Cys-124和Cys-71之间形成二硫键使PTEN失去活性,从而增强其稳定性并阻止其向膜募集,见图2.其次,H2O2还可以诱导PTEN的翻译后修饰,例如S-亚硝基化(SNO),其有助于增强泛素蛋白酶体功能,导致PTEN失活和降解.PTEN的失活不仅减轻了对Akt信号通路的抑制,而且也使抑制PCa细胞增殖的NKX3.1基因表达明显降低[23].Akt被氧化应激激活后热休克蛋白27活性也随之增强,不仅可以防止AR降解,且可通过十六烷酰化修饰AR,促进AR核定位[24,25],见图2.叉头框蛋白O亚族3a(FOXO3a)作为Akt下游的靶基因,与AR启动子区域的FOXO反应元件结合促进AR转录,可以推动CRPC的演进[26].在MAPK信号通路中,凋亡信号调节激酶(apoptosissignal regulatingkinase 1,ASK1)是上游MAPKKK中的一种,使MKK4、MKK3和MKK6磷酸化并调节JNK和p38MAPK通路.ASK1以硫氧还蛋白(TRX)-ASK复合物的形式被ROS激活[27].TRX是一种氧化还原调节蛋白,具有感应ROS水平和维持细胞内氧化还原状态以及调节ASK1活性的作用.在休眠细胞中,还原形式的TRX与ASK1的N端结构域结合,并通过其N端螺旋结构域干扰活性同源寡聚体的形成,从而使ASK1保持非活性状态.H2O2产生后,TRX转变成氧化形式并从ASK1中解离,触发ASK1自磷酸化且获得激酶活性[28],见图2.JNK信号通路被激活后触发了下游靶基因的转录,如甾醇调节元件结合蛋白(SREBP),见图2.在LNCaP细胞中SREBP-1可以与AR启动子结合影响AR转录促进PCa细胞增殖,同时通过诱导Nox5表达,提高ROS水平[29]. ...
Plk1 inhibition enhances the efficacy of androgen signaling blockade in castration-resistant prostate cancer
1
2014
... 研究表明,接受ADT后的CRPC患者瘤内局部雄激素水平与未接受激素治疗的患者相似.虽然目前没有直接证据表明氧化应激可促进PCa的雄激素合成,但一些研究提示氧化应激与类固醇生成之间存在关系.如前所述,氧化应激通过PI3K/Akt信号通路激活下游SREBP基因,促进脂质合成酶的表达,如脂肪酸合酶、羟甲基戊二酸单酰辅酶A还原酶和低密度脂蛋白胆固醇受体,导致脂质合成增加,并通过从头合成途径提高瘤内局部雄激素水平[30].患者接受ADT后体内超氧化物歧化酶2的表达水平下降,不仅提高了体内氧化应激水平,而且使几个参与类固醇代谢的基因表达升高,例如醛酮还原酶1C3、羟基类固醇17-β脱氢酶、11β-羟化类固醇脱氢酶2等,使肾上腺雄烯二酮转化为睾酮,从而激活AR信号[31,32],见图2.这些研究均表明氧化应激在PCa细胞中有促进雄激素合成的可能性. ...
Effects of manganese superoxide dismutase silencing on androgen receptor function and gene regulation:implications for castration-resistant prostate cancer
1
2008
... 研究表明,接受ADT后的CRPC患者瘤内局部雄激素水平与未接受激素治疗的患者相似.虽然目前没有直接证据表明氧化应激可促进PCa的雄激素合成,但一些研究提示氧化应激与类固醇生成之间存在关系.如前所述,氧化应激通过PI3K/Akt信号通路激活下游SREBP基因,促进脂质合成酶的表达,如脂肪酸合酶、羟甲基戊二酸单酰辅酶A还原酶和低密度脂蛋白胆固醇受体,导致脂质合成增加,并通过从头合成途径提高瘤内局部雄激素水平[30].患者接受ADT后体内超氧化物歧化酶2的表达水平下降,不仅提高了体内氧化应激水平,而且使几个参与类固醇代谢的基因表达升高,例如醛酮还原酶1C3、羟基类固醇17-β脱氢酶、11β-羟化类固醇脱氢酶2等,使肾上腺雄烯二酮转化为睾酮,从而激活AR信号[31,32],见图2.这些研究均表明氧化应激在PCa细胞中有促进雄激素合成的可能性. ...
11-Oxygenated androgen precursors are the preferred substrates for aldo-keto reductase 1C3(AKR1C3):Implications for castration resistant prostate cancer
1
2018
... 研究表明,接受ADT后的CRPC患者瘤内局部雄激素水平与未接受激素治疗的患者相似.虽然目前没有直接证据表明氧化应激可促进PCa的雄激素合成,但一些研究提示氧化应激与类固醇生成之间存在关系.如前所述,氧化应激通过PI3K/Akt信号通路激活下游SREBP基因,促进脂质合成酶的表达,如脂肪酸合酶、羟甲基戊二酸单酰辅酶A还原酶和低密度脂蛋白胆固醇受体,导致脂质合成增加,并通过从头合成途径提高瘤内局部雄激素水平[30].患者接受ADT后体内超氧化物歧化酶2的表达水平下降,不仅提高了体内氧化应激水平,而且使几个参与类固醇代谢的基因表达升高,例如醛酮还原酶1C3、羟基类固醇17-β脱氢酶、11β-羟化类固醇脱氢酶2等,使肾上腺雄烯二酮转化为睾酮,从而激活AR信号[31,32],见图2.这些研究均表明氧化应激在PCa细胞中有促进雄激素合成的可能性. ...
TXNDC9 regulates oxidative stress-induced androgen receptor signaling to promote prostate cancer progression
2
2020
... 通过对基因研究发现,硫氧还蛋白域9(TXNDC9)是ROS诱导剂衣霉素最显著上调的TRX,也是氧化应激条件下触发AR信号通路的重要调节剂.例如,在没有ROS诱导剂时,沉默TXNDC9基因导致LNCaP细胞系活力降低,TXNDC9基因过表达也没能恢复细胞活力,但加入ROS诱导剂后细胞活力和AR活性均有所提高,并且不能被沉默TXNDC9所干扰[33].同时,过氧化物氧化还原酶蛋白1(Prx1)是TXNDC9主要的相互蛋白,两者在形成同二聚体时起着抗ROS的作用[33].然而,与过氧化氢酶或谷胱甘肽过氧化物酶相比,Prx1的催化能力相对较弱,在H2O2催化过程中很容易失活.首先,在ROS诱导剂刺激下,TXNDC9上调并与Prx1解离,一方面通过促进TXNDC9介导的E3泛素连接酶MDM2的降解来激活AR信号传导,另一方面通过直接增强Prx1结合AR的能力,稳定AR蛋白.其次,被ROS诱导剂处理后,Prx1形成聚合物从抗氧化剂功能切换到AR分子伴侣功能,增加双氢睾酮(DHT)和AR N-C相互作用的亲和力,降低DHT与受体解离速率,稳定DHT-AR复合物,使AR在低雄激素环境下仍然保持活化状态;相反,Prx1基因敲除则使AR信号活性降低了50%左右[34],见图2.因此,PCa患者经过ADT后虽然阻断了雄激素的主要来源,但提高了AR的敏感性,使其与少量肾上腺来源的雄激素结合能力增强. ...
... [33].然而,与过氧化氢酶或谷胱甘肽过氧化物酶相比,Prx1的催化能力相对较弱,在H2O2催化过程中很容易失活.首先,在ROS诱导剂刺激下,TXNDC9上调并与Prx1解离,一方面通过促进TXNDC9介导的E3泛素连接酶MDM2的降解来激活AR信号传导,另一方面通过直接增强Prx1结合AR的能力,稳定AR蛋白.其次,被ROS诱导剂处理后,Prx1形成聚合物从抗氧化剂功能切换到AR分子伴侣功能,增加双氢睾酮(DHT)和AR N-C相互作用的亲和力,降低DHT与受体解离速率,稳定DHT-AR复合物,使AR在低雄激素环境下仍然保持活化状态;相反,Prx1基因敲除则使AR信号活性降低了50%左右[34],见图2.因此,PCa患者经过ADT后虽然阻断了雄激素的主要来源,但提高了AR的敏感性,使其与少量肾上腺来源的雄激素结合能力增强. ...
Prx1 enhances androgen receptor function in prostate cancer cells by increasing receptor affinity to dihydrotestosterone
1
2009
... 通过对基因研究发现,硫氧还蛋白域9(TXNDC9)是ROS诱导剂衣霉素最显著上调的TRX,也是氧化应激条件下触发AR信号通路的重要调节剂.例如,在没有ROS诱导剂时,沉默TXNDC9基因导致LNCaP细胞系活力降低,TXNDC9基因过表达也没能恢复细胞活力,但加入ROS诱导剂后细胞活力和AR活性均有所提高,并且不能被沉默TXNDC9所干扰[33].同时,过氧化物氧化还原酶蛋白1(Prx1)是TXNDC9主要的相互蛋白,两者在形成同二聚体时起着抗ROS的作用[33].然而,与过氧化氢酶或谷胱甘肽过氧化物酶相比,Prx1的催化能力相对较弱,在H2O2催化过程中很容易失活.首先,在ROS诱导剂刺激下,TXNDC9上调并与Prx1解离,一方面通过促进TXNDC9介导的E3泛素连接酶MDM2的降解来激活AR信号传导,另一方面通过直接增强Prx1结合AR的能力,稳定AR蛋白.其次,被ROS诱导剂处理后,Prx1形成聚合物从抗氧化剂功能切换到AR分子伴侣功能,增加双氢睾酮(DHT)和AR N-C相互作用的亲和力,降低DHT与受体解离速率,稳定DHT-AR复合物,使AR在低雄激素环境下仍然保持活化状态;相反,Prx1基因敲除则使AR信号活性降低了50%左右[34],见图2.因此,PCa患者经过ADT后虽然阻断了雄激素的主要来源,但提高了AR的敏感性,使其与少量肾上腺来源的雄激素结合能力增强. ...
The role of TXNDC5 in castration-resistant prostate cancer-involvement of androgen receptor signaling pathway
1
2015
... 除TXNDC9外,硫氧还蛋白域5(TXNDC5)也是TRX家族成员之一,在PCa患者接受ADT后表达上调,并通过硫氧还蛋白结构域形成二硫键,促进蛋白质正确折叠和分子伴侣活性,从3个方面增强与AR之间的相互作用:(1)TXNDC5能稳定AR结构,促进其核转位;(2)TXNDC5诱导HSP90分子伴侣复合物的组装,稳定AR的功能;(3)TXNDC5能提高AR对多种配体的敏感性,使AR对恩扎鲁胺产生抗药性[35].同时,TXNDC5的表达与ROS介导的缺氧诱导因子-1α(HIF-1α)呈正相关,首先H2O2介导NF-κB与HIF-1α启动子上游的结合位点(-197/-188bp)结合,直接激活HIF-1α转录;其次H2O2促进核糖体蛋白S6激酶活化,提高HIF-1α的翻译率[36,37].总之,在转录和翻译水平上,ROS通过介导HIF-1α的表达,上调TXNDC5在PCa细胞中的含量,稳定AR功能,以及提高AR对低水平雄激素的敏感性. ...
Role of TXNDC5 in tumorigenesis of colorectal cancer cells:In vivo and in vitro evidence
1
2018
... 除TXNDC9外,硫氧还蛋白域5(TXNDC5)也是TRX家族成员之一,在PCa患者接受ADT后表达上调,并通过硫氧还蛋白结构域形成二硫键,促进蛋白质正确折叠和分子伴侣活性,从3个方面增强与AR之间的相互作用:(1)TXNDC5能稳定AR结构,促进其核转位;(2)TXNDC5诱导HSP90分子伴侣复合物的组装,稳定AR的功能;(3)TXNDC5能提高AR对多种配体的敏感性,使AR对恩扎鲁胺产生抗药性[35].同时,TXNDC5的表达与ROS介导的缺氧诱导因子-1α(HIF-1α)呈正相关,首先H2O2介导NF-κB与HIF-1α启动子上游的结合位点(-197/-188bp)结合,直接激活HIF-1α转录;其次H2O2促进核糖体蛋白S6激酶活化,提高HIF-1α的翻译率[36,37].总之,在转录和翻译水平上,ROS通过介导HIF-1α的表达,上调TXNDC5在PCa细胞中的含量,稳定AR功能,以及提高AR对低水平雄激素的敏感性. ...
Maintenance of redox homeostasis by hypoxia-inducible factors
1
2017
... 除TXNDC9外,硫氧还蛋白域5(TXNDC5)也是TRX家族成员之一,在PCa患者接受ADT后表达上调,并通过硫氧还蛋白结构域形成二硫键,促进蛋白质正确折叠和分子伴侣活性,从3个方面增强与AR之间的相互作用:(1)TXNDC5能稳定AR结构,促进其核转位;(2)TXNDC5诱导HSP90分子伴侣复合物的组装,稳定AR的功能;(3)TXNDC5能提高AR对多种配体的敏感性,使AR对恩扎鲁胺产生抗药性[35].同时,TXNDC5的表达与ROS介导的缺氧诱导因子-1α(HIF-1α)呈正相关,首先H2O2介导NF-κB与HIF-1α启动子上游的结合位点(-197/-188bp)结合,直接激活HIF-1α转录;其次H2O2促进核糖体蛋白S6激酶活化,提高HIF-1α的翻译率[36,37].总之,在转录和翻译水平上,ROS通过介导HIF-1α的表达,上调TXNDC5在PCa细胞中的含量,稳定AR功能,以及提高AR对低水平雄激素的敏感性. ...
Redox regulation of the tumor suppressor PTEN by hydrogen peroxide and tert-butyl hydroperoxide
1
2017
... 在CRPC发展过程中,ROS通过激活肿瘤相关信号通路使AR信号以不依赖雄激素的方式被激活,这些信号通路被称为"旁路途经".H2O2通过氧化半胱氨酸残基抑制受体酪氨酸激酶的蛋白质酪氨酸磷酸酶(PTPs)活性降低,使受体酪氨酸激酶持续活化,如表皮生长因子受体和血小板衍生生长因子受体等,导致PI3K/Akt信号通路激活[38],见图2.AR信号通路与PI3K/Akt/mTOR信号通路之间存在双向关联,当AR信号通路被抑制时,可通过下调靶基因FKBP5的表达,抑制Akt去磷酸化,从而增强PI3K/Akt/mTOR信号通路,促进肿瘤生长[39].Akt下游的靶基因叉头框蛋白A1(FOXA1)与AR结合并共同定位于含有GATA2转录因子的染色质上,增强类固醇受体共激活子向FOXA1-AR复合物的募集,促进AR下游基因表达[40]. ...
Inhibition of autophagy promotes salinomycin-induced apoptosis via reactive oxygen species-mediated PI3K/AKT/mTOR and ERK/p38 MAPK-dependent signaling in human prostate cancer cells
1
2017
... 在CRPC发展过程中,ROS通过激活肿瘤相关信号通路使AR信号以不依赖雄激素的方式被激活,这些信号通路被称为"旁路途经".H2O2通过氧化半胱氨酸残基抑制受体酪氨酸激酶的蛋白质酪氨酸磷酸酶(PTPs)活性降低,使受体酪氨酸激酶持续活化,如表皮生长因子受体和血小板衍生生长因子受体等,导致PI3K/Akt信号通路激活[38],见图2.AR信号通路与PI3K/Akt/mTOR信号通路之间存在双向关联,当AR信号通路被抑制时,可通过下调靶基因FKBP5的表达,抑制Akt去磷酸化,从而增强PI3K/Akt/mTOR信号通路,促进肿瘤生长[39].Akt下游的靶基因叉头框蛋白A1(FOXA1)与AR结合并共同定位于含有GATA2转录因子的染色质上,增强类固醇受体共激活子向FOXA1-AR复合物的募集,促进AR下游基因表达[40]. ...
FOXA1 Acts upstream of GATA2 and AR in hormonal regulation of gene expression
1
2016
... 在CRPC发展过程中,ROS通过激活肿瘤相关信号通路使AR信号以不依赖雄激素的方式被激活,这些信号通路被称为"旁路途经".H2O2通过氧化半胱氨酸残基抑制受体酪氨酸激酶的蛋白质酪氨酸磷酸酶(PTPs)活性降低,使受体酪氨酸激酶持续活化,如表皮生长因子受体和血小板衍生生长因子受体等,导致PI3K/Akt信号通路激活[38],见图2.AR信号通路与PI3K/Akt/mTOR信号通路之间存在双向关联,当AR信号通路被抑制时,可通过下调靶基因FKBP5的表达,抑制Akt去磷酸化,从而增强PI3K/Akt/mTOR信号通路,促进肿瘤生长[39].Akt下游的靶基因叉头框蛋白A1(FOXA1)与AR结合并共同定位于含有GATA2转录因子的染色质上,增强类固醇受体共激活子向FOXA1-AR复合物的募集,促进AR下游基因表达[40]. ...
ERK regulates calpain 2-induced androgen receptor proteolysis in CWR22 relapsed prostate tumor cell lines
1
2010
... H2O2还可以通过激活表皮生长因子受体和血小板衍生生长因子受体,刺激Ras和随后的细胞外信号调节激酶(ERK)通路激活.一方面,ERK磷酸化能够促进AR蛋白质降解,提高低分子量AR的水平,使其能够以非雄激素依赖的方式进入细胞核与DNA结合,激活或抑制靶基因的转录;另一方面,ERK激酶还可以磷酸化并激活AR辅助调节因子,如NCOA1和NCOA2,促进靶基因转录[41].见图2. ...
Role of interleukin-6 in cancer progression and therapeutic resistance
1
2016
... 氧化应激激活p38MAPK信号通路后,下游的激活蛋白1(AP-1)与白介素6(IL-6)基因启动子区结合调控IL-6的表达,此外,如前所述与氧化应激相关的几个转录因子如NF-κB和CREB,以同样方式也参与调节IL-6的表达[42],见图2.随后IL-6以配体非依赖途径调控AR活性,促进CRPC演进.首先,IL-6可以替代雄激素功能激活经典的Janus激酶(JAK)/信号转导与转录激活因子(STAT)信号通路[43].在下游靶基因中,STAT5诱导AR核定位并调控AR转录活性激活AR信号通路;STAT3与AR氨基酸N端相互作用并增强AR活性和功能[44],见图2.其次,IL-6与IL-6受体JAK结合后,JAK导致含Src同源2结构域的蛋白酪氨酸磷酸酶磷酸化,通过激活Ras并触发一系列连锁事件,使MAPK磷酸化,最终激活AR氨基N端结构域,提高AR靶基因的转录活性[45].IL-6的过度表达也提升了LNCaP细胞中PSA mRNA的表达水平,通过上调翻译起始因子eIF4A(TIF2)使其在没有配体的情况下诱导AR活性,保护LNCaP细胞免受ADT诱导的细胞凋亡[46].见图2. ...
Inhibition of IL-6-JAK/Stat3 signaling in castration-resistant prostate cancer cells enhances the NK cell-mediated cytotoxicity via alteration of PD-L1/NKG2D ligand levels
1
2018
... 氧化应激激活p38MAPK信号通路后,下游的激活蛋白1(AP-1)与白介素6(IL-6)基因启动子区结合调控IL-6的表达,此外,如前所述与氧化应激相关的几个转录因子如NF-κB和CREB,以同样方式也参与调节IL-6的表达[42],见图2.随后IL-6以配体非依赖途径调控AR活性,促进CRPC演进.首先,IL-6可以替代雄激素功能激活经典的Janus激酶(JAK)/信号转导与转录激活因子(STAT)信号通路[43].在下游靶基因中,STAT5诱导AR核定位并调控AR转录活性激活AR信号通路;STAT3与AR氨基酸N端相互作用并增强AR活性和功能[44],见图2.其次,IL-6与IL-6受体JAK结合后,JAK导致含Src同源2结构域的蛋白酪氨酸磷酸酶磷酸化,通过激活Ras并触发一系列连锁事件,使MAPK磷酸化,最终激活AR氨基N端结构域,提高AR靶基因的转录活性[45].IL-6的过度表达也提升了LNCaP细胞中PSA mRNA的表达水平,通过上调翻译起始因子eIF4A(TIF2)使其在没有配体的情况下诱导AR活性,保护LNCaP细胞免受ADT诱导的细胞凋亡[46].见图2. ...
STAT3 and STAT5A are potential therapeutic targets in castration-resistant prostate cancer
1
2017
... 氧化应激激活p38MAPK信号通路后,下游的激活蛋白1(AP-1)与白介素6(IL-6)基因启动子区结合调控IL-6的表达,此外,如前所述与氧化应激相关的几个转录因子如NF-κB和CREB,以同样方式也参与调节IL-6的表达[42],见图2.随后IL-6以配体非依赖途径调控AR活性,促进CRPC演进.首先,IL-6可以替代雄激素功能激活经典的Janus激酶(JAK)/信号转导与转录激活因子(STAT)信号通路[43].在下游靶基因中,STAT5诱导AR核定位并调控AR转录活性激活AR信号通路;STAT3与AR氨基酸N端相互作用并增强AR活性和功能[44],见图2.其次,IL-6与IL-6受体JAK结合后,JAK导致含Src同源2结构域的蛋白酪氨酸磷酸酶磷酸化,通过激活Ras并触发一系列连锁事件,使MAPK磷酸化,最终激活AR氨基N端结构域,提高AR靶基因的转录活性[45].IL-6的过度表达也提升了LNCaP细胞中PSA mRNA的表达水平,通过上调翻译起始因子eIF4A(TIF2)使其在没有配体的情况下诱导AR活性,保护LNCaP细胞免受ADT诱导的细胞凋亡[46].见图2. ...
Impact of the N-terminal domain of STAT3 in STAT3-dependent transcriptional activity
1
2015
... 氧化应激激活p38MAPK信号通路后,下游的激活蛋白1(AP-1)与白介素6(IL-6)基因启动子区结合调控IL-6的表达,此外,如前所述与氧化应激相关的几个转录因子如NF-κB和CREB,以同样方式也参与调节IL-6的表达[42],见图2.随后IL-6以配体非依赖途径调控AR活性,促进CRPC演进.首先,IL-6可以替代雄激素功能激活经典的Janus激酶(JAK)/信号转导与转录激活因子(STAT)信号通路[43].在下游靶基因中,STAT5诱导AR核定位并调控AR转录活性激活AR信号通路;STAT3与AR氨基酸N端相互作用并增强AR活性和功能[44],见图2.其次,IL-6与IL-6受体JAK结合后,JAK导致含Src同源2结构域的蛋白酪氨酸磷酸酶磷酸化,通过激活Ras并触发一系列连锁事件,使MAPK磷酸化,最终激活AR氨基N端结构域,提高AR靶基因的转录活性[45].IL-6的过度表达也提升了LNCaP细胞中PSA mRNA的表达水平,通过上调翻译起始因子eIF4A(TIF2)使其在没有配体的情况下诱导AR活性,保护LNCaP细胞免受ADT诱导的细胞凋亡[46].见图2. ...
Interleukin-6 increases prostate cancer cells resistance to bicalutamide via TIF2
1
2009
... 氧化应激激活p38MAPK信号通路后,下游的激活蛋白1(AP-1)与白介素6(IL-6)基因启动子区结合调控IL-6的表达,此外,如前所述与氧化应激相关的几个转录因子如NF-κB和CREB,以同样方式也参与调节IL-6的表达[42],见图2.随后IL-6以配体非依赖途径调控AR活性,促进CRPC演进.首先,IL-6可以替代雄激素功能激活经典的Janus激酶(JAK)/信号转导与转录激活因子(STAT)信号通路[43].在下游靶基因中,STAT5诱导AR核定位并调控AR转录活性激活AR信号通路;STAT3与AR氨基酸N端相互作用并增强AR活性和功能[44],见图2.其次,IL-6与IL-6受体JAK结合后,JAK导致含Src同源2结构域的蛋白酪氨酸磷酸酶磷酸化,通过激活Ras并触发一系列连锁事件,使MAPK磷酸化,最终激活AR氨基N端结构域,提高AR靶基因的转录活性[45].IL-6的过度表达也提升了LNCaP细胞中PSA mRNA的表达水平,通过上调翻译起始因子eIF4A(TIF2)使其在没有配体的情况下诱导AR活性,保护LNCaP细胞免受ADT诱导的细胞凋亡[46].见图2. ...
Co-carcinogenic effects of vitamin E in prostate
1
2019
... 维生素E是一种抗氧化剂,由8种天然亚型组成,即生育酚的α、β、γ、δ亚型和生育三烯酚的α、β、γ、δ亚型,其中γ-生育酚和δ-生育酚在色原醇环C-5位置上有未甲基化,因此具有更强的抗氧化能力.大量的基础研究和观察性研究表明,维生素E具有抗氧化和预防癌症的作用,但大规模人体干预试验的结果却显示其增加了PCa的发病率[47];α-生育酚可能增加患PCa的风险,而γ-生育酚可能降低这种风险[48].γ-生育酚已被证明可以防止核因子E2相关因子2(Nrf-2)启动子区域CpG基因的高甲基化,有助于预防氧化应激和PCa的发生、发展,降低PCa患者死亡的风险[49];并且,γ-生育酚的终末氧化产物γ-生育酚醌,比α-生育酚醌能更有效地提高Nrf-2辅助激活转录因子4的转录活性和细胞抗氧化剂谷胱甘肽的水平[50].番茄红素是一种具有抗氧化特性的类胡萝卜素,通过清除自由基和诱导细胞凋亡发挥其抗氧化作用[51].一项研究发现,在睾丸切除术中加用番茄红素可使血清PSA水平持续下降,不仅缩小了原发肿瘤,而且减少了继发肿瘤,与单纯睾丸切除术相比提高了患者生存率[52].同样,在PC-346C人PCa小鼠模型中,番茄红素和维生素E的联合可以抑制PCa细胞的生长[53].以上研究提示单纯通过降低ROS和氧化应激水平对PCa的抑制作用并不明显. ...
Dietary antioxidants and prostate cancer:a review
1
2013
... 维生素E是一种抗氧化剂,由8种天然亚型组成,即生育酚的α、β、γ、δ亚型和生育三烯酚的α、β、γ、δ亚型,其中γ-生育酚和δ-生育酚在色原醇环C-5位置上有未甲基化,因此具有更强的抗氧化能力.大量的基础研究和观察性研究表明,维生素E具有抗氧化和预防癌症的作用,但大规模人体干预试验的结果却显示其增加了PCa的发病率[47];α-生育酚可能增加患PCa的风险,而γ-生育酚可能降低这种风险[48].γ-生育酚已被证明可以防止核因子E2相关因子2(Nrf-2)启动子区域CpG基因的高甲基化,有助于预防氧化应激和PCa的发生、发展,降低PCa患者死亡的风险[49];并且,γ-生育酚的终末氧化产物γ-生育酚醌,比α-生育酚醌能更有效地提高Nrf-2辅助激活转录因子4的转录活性和细胞抗氧化剂谷胱甘肽的水平[50].番茄红素是一种具有抗氧化特性的类胡萝卜素,通过清除自由基和诱导细胞凋亡发挥其抗氧化作用[51].一项研究发现,在睾丸切除术中加用番茄红素可使血清PSA水平持续下降,不仅缩小了原发肿瘤,而且减少了继发肿瘤,与单纯睾丸切除术相比提高了患者生存率[52].同样,在PC-346C人PCa小鼠模型中,番茄红素和维生素E的联合可以抑制PCa细胞的生长[53].以上研究提示单纯通过降低ROS和氧化应激水平对PCa的抑制作用并不明显. ...
A γ-tocopherol-rich mixture of tocopherols maintains Nrf2 expression in prostate tumors of TRAMP mice via epigenetic inhibition of CpG methylation
1
2012
... 维生素E是一种抗氧化剂,由8种天然亚型组成,即生育酚的α、β、γ、δ亚型和生育三烯酚的α、β、γ、δ亚型,其中γ-生育酚和δ-生育酚在色原醇环C-5位置上有未甲基化,因此具有更强的抗氧化能力.大量的基础研究和观察性研究表明,维生素E具有抗氧化和预防癌症的作用,但大规模人体干预试验的结果却显示其增加了PCa的发病率[47];α-生育酚可能增加患PCa的风险,而γ-生育酚可能降低这种风险[48].γ-生育酚已被证明可以防止核因子E2相关因子2(Nrf-2)启动子区域CpG基因的高甲基化,有助于预防氧化应激和PCa的发生、发展,降低PCa患者死亡的风险[49];并且,γ-生育酚的终末氧化产物γ-生育酚醌,比α-生育酚醌能更有效地提高Nrf-2辅助激活转录因子4的转录活性和细胞抗氧化剂谷胱甘肽的水平[50].番茄红素是一种具有抗氧化特性的类胡萝卜素,通过清除自由基和诱导细胞凋亡发挥其抗氧化作用[51].一项研究发现,在睾丸切除术中加用番茄红素可使血清PSA水平持续下降,不仅缩小了原发肿瘤,而且减少了继发肿瘤,与单纯睾丸切除术相比提高了患者生存率[52].同样,在PC-346C人PCa小鼠模型中,番茄红素和维生素E的联合可以抑制PCa细胞的生长[53].以上研究提示单纯通过降低ROS和氧化应激水平对PCa的抑制作用并不明显. ...
Gamma-tocopheryl quinone,not alpha-tocopheryl quinone,induces adaptive response through up-regulation of cellular glutathione and cysteine availability via activation of ATF4
1
2008
... 维生素E是一种抗氧化剂,由8种天然亚型组成,即生育酚的α、β、γ、δ亚型和生育三烯酚的α、β、γ、δ亚型,其中γ-生育酚和δ-生育酚在色原醇环C-5位置上有未甲基化,因此具有更强的抗氧化能力.大量的基础研究和观察性研究表明,维生素E具有抗氧化和预防癌症的作用,但大规模人体干预试验的结果却显示其增加了PCa的发病率[47];α-生育酚可能增加患PCa的风险,而γ-生育酚可能降低这种风险[48].γ-生育酚已被证明可以防止核因子E2相关因子2(Nrf-2)启动子区域CpG基因的高甲基化,有助于预防氧化应激和PCa的发生、发展,降低PCa患者死亡的风险[49];并且,γ-生育酚的终末氧化产物γ-生育酚醌,比α-生育酚醌能更有效地提高Nrf-2辅助激活转录因子4的转录活性和细胞抗氧化剂谷胱甘肽的水平[50].番茄红素是一种具有抗氧化特性的类胡萝卜素,通过清除自由基和诱导细胞凋亡发挥其抗氧化作用[51].一项研究发现,在睾丸切除术中加用番茄红素可使血清PSA水平持续下降,不仅缩小了原发肿瘤,而且减少了继发肿瘤,与单纯睾丸切除术相比提高了患者生存率[52].同样,在PC-346C人PCa小鼠模型中,番茄红素和维生素E的联合可以抑制PCa细胞的生长[53].以上研究提示单纯通过降低ROS和氧化应激水平对PCa的抑制作用并不明显. ...
Potential inhibitory effect of lycopene on prostate cancer
1
2020
... 维生素E是一种抗氧化剂,由8种天然亚型组成,即生育酚的α、β、γ、δ亚型和生育三烯酚的α、β、γ、δ亚型,其中γ-生育酚和δ-生育酚在色原醇环C-5位置上有未甲基化,因此具有更强的抗氧化能力.大量的基础研究和观察性研究表明,维生素E具有抗氧化和预防癌症的作用,但大规模人体干预试验的结果却显示其增加了PCa的发病率[47];α-生育酚可能增加患PCa的风险,而γ-生育酚可能降低这种风险[48].γ-生育酚已被证明可以防止核因子E2相关因子2(Nrf-2)启动子区域CpG基因的高甲基化,有助于预防氧化应激和PCa的发生、发展,降低PCa患者死亡的风险[49];并且,γ-生育酚的终末氧化产物γ-生育酚醌,比α-生育酚醌能更有效地提高Nrf-2辅助激活转录因子4的转录活性和细胞抗氧化剂谷胱甘肽的水平[50].番茄红素是一种具有抗氧化特性的类胡萝卜素,通过清除自由基和诱导细胞凋亡发挥其抗氧化作用[51].一项研究发现,在睾丸切除术中加用番茄红素可使血清PSA水平持续下降,不仅缩小了原发肿瘤,而且减少了继发肿瘤,与单纯睾丸切除术相比提高了患者生存率[52].同样,在PC-346C人PCa小鼠模型中,番茄红素和维生素E的联合可以抑制PCa细胞的生长[53].以上研究提示单纯通过降低ROS和氧化应激水平对PCa的抑制作用并不明显. ...
A comparison of lycopene and orchidectomy vs orchidectomy alone in the management of advanced prostate cancer
1
2005
... 维生素E是一种抗氧化剂,由8种天然亚型组成,即生育酚的α、β、γ、δ亚型和生育三烯酚的α、β、γ、δ亚型,其中γ-生育酚和δ-生育酚在色原醇环C-5位置上有未甲基化,因此具有更强的抗氧化能力.大量的基础研究和观察性研究表明,维生素E具有抗氧化和预防癌症的作用,但大规模人体干预试验的结果却显示其增加了PCa的发病率[47];α-生育酚可能增加患PCa的风险,而γ-生育酚可能降低这种风险[48].γ-生育酚已被证明可以防止核因子E2相关因子2(Nrf-2)启动子区域CpG基因的高甲基化,有助于预防氧化应激和PCa的发生、发展,降低PCa患者死亡的风险[49];并且,γ-生育酚的终末氧化产物γ-生育酚醌,比α-生育酚醌能更有效地提高Nrf-2辅助激活转录因子4的转录活性和细胞抗氧化剂谷胱甘肽的水平[50].番茄红素是一种具有抗氧化特性的类胡萝卜素,通过清除自由基和诱导细胞凋亡发挥其抗氧化作用[51].一项研究发现,在睾丸切除术中加用番茄红素可使血清PSA水平持续下降,不仅缩小了原发肿瘤,而且减少了继发肿瘤,与单纯睾丸切除术相比提高了患者生存率[52].同样,在PC-346C人PCa小鼠模型中,番茄红素和维生素E的联合可以抑制PCa细胞的生长[53].以上研究提示单纯通过降低ROS和氧化应激水平对PCa的抑制作用并不明显. ...
Combined lycopene and vitamin E treatment suppresses the growth of PC-346C human prostate cancer cells in nude mice
1
2006
... 维生素E是一种抗氧化剂,由8种天然亚型组成,即生育酚的α、β、γ、δ亚型和生育三烯酚的α、β、γ、δ亚型,其中γ-生育酚和δ-生育酚在色原醇环C-5位置上有未甲基化,因此具有更强的抗氧化能力.大量的基础研究和观察性研究表明,维生素E具有抗氧化和预防癌症的作用,但大规模人体干预试验的结果却显示其增加了PCa的发病率[47];α-生育酚可能增加患PCa的风险,而γ-生育酚可能降低这种风险[48].γ-生育酚已被证明可以防止核因子E2相关因子2(Nrf-2)启动子区域CpG基因的高甲基化,有助于预防氧化应激和PCa的发生、发展,降低PCa患者死亡的风险[49];并且,γ-生育酚的终末氧化产物γ-生育酚醌,比α-生育酚醌能更有效地提高Nrf-2辅助激活转录因子4的转录活性和细胞抗氧化剂谷胱甘肽的水平[50].番茄红素是一种具有抗氧化特性的类胡萝卜素,通过清除自由基和诱导细胞凋亡发挥其抗氧化作用[51].一项研究发现,在睾丸切除术中加用番茄红素可使血清PSA水平持续下降,不仅缩小了原发肿瘤,而且减少了继发肿瘤,与单纯睾丸切除术相比提高了患者生存率[52].同样,在PC-346C人PCa小鼠模型中,番茄红素和维生素E的联合可以抑制PCa细胞的生长[53].以上研究提示单纯通过降低ROS和氧化应激水平对PCa的抑制作用并不明显. ...
Perspectives of the Nrf-2 signaling pathway in cancer progression and therapy
1
2017
... Nrf-2是调节抗氧化反应元件的主要转录因子,通过调节血氧合酶1(HO-1)、NADPH-醌氧化还原酶1(NQO1)、谷胱甘肽S-转移酶A2(GSTA2)等抗氧化物酶,调节ROS水平[54].正常情况下,细胞质中Nrf-2与抑制蛋白Keap1结合,通过泛素蛋白酶体途径促进其降解.氧化应激导致NF-κB释放和核易位,并在转录水平直接抑制Nrf-2活性.通过使用能够激活Nrf-2的治疗剂,可以预防PCa转化为CRPC[55].在PCa中激活Nrf-2不仅能调节氧化应激水平,而且还可以通过诱导p120-Nrf1的核积累来降低AR的反式激活,以及抑制DHT诱导的AR活性[56].目前发现,甲基巴多索隆是一种强效的Nrf-2诱导剂,通过降低AR-FL和AR-V7抑制AR功能,提高耐恩杂鲁胺PCa细胞系(CWR22RV1)中恩杂鲁胺的疗效,可以作为PCa患者接受ADT时的辅助治疗[57].莱菔硫烷(SFN)在PCa中发挥作用的两个关键途径是Nrf-2激活和NF-κB抑制.首先,SFN与Keap-1相互作用,消除对Nrf-2的抑制作用,增加小鼠TRAMP C1 PCa细胞Nrf-2的表达,抑制AR转录以及降低PCa细胞中AR的稳定性[58];SFN也可以通过降解PCa细胞系中AR-FL和AR-V7,提高雄激素依赖性和雄激素非依赖性PCa细胞系抗雄激素的疗效[58].其次,SFN通过阻碍IKK/IκB磷酸化和p65 NF-κB亚基核易位,阻断NF-κB信号传导,抑制AR表达[59].与SFN相似,在小鼠TRAMP C1 PCa细胞中,姜黄素(CUR)被认为是Keap1抑制剂,通过修饰Keap1 Cys-151的亲电性,降低Keap1表达,促进Nrf-2解离,并下调雄激素依赖性和雄激素非依赖性PCa细胞中AR基因的表达和活性[60,61]. ...
Targeting crosstalk between nrf-2,NF-κB and androgen receptor signaling in prostate cancer
1
2018
... Nrf-2是调节抗氧化反应元件的主要转录因子,通过调节血氧合酶1(HO-1)、NADPH-醌氧化还原酶1(NQO1)、谷胱甘肽S-转移酶A2(GSTA2)等抗氧化物酶,调节ROS水平[54].正常情况下,细胞质中Nrf-2与抑制蛋白Keap1结合,通过泛素蛋白酶体途径促进其降解.氧化应激导致NF-κB释放和核易位,并在转录水平直接抑制Nrf-2活性.通过使用能够激活Nrf-2的治疗剂,可以预防PCa转化为CRPC[55].在PCa中激活Nrf-2不仅能调节氧化应激水平,而且还可以通过诱导p120-Nrf1的核积累来降低AR的反式激活,以及抑制DHT诱导的AR活性[56].目前发现,甲基巴多索隆是一种强效的Nrf-2诱导剂,通过降低AR-FL和AR-V7抑制AR功能,提高耐恩杂鲁胺PCa细胞系(CWR22RV1)中恩杂鲁胺的疗效,可以作为PCa患者接受ADT时的辅助治疗[57].莱菔硫烷(SFN)在PCa中发挥作用的两个关键途径是Nrf-2激活和NF-κB抑制.首先,SFN与Keap-1相互作用,消除对Nrf-2的抑制作用,增加小鼠TRAMP C1 PCa细胞Nrf-2的表达,抑制AR转录以及降低PCa细胞中AR的稳定性[58];SFN也可以通过降解PCa细胞系中AR-FL和AR-V7,提高雄激素依赖性和雄激素非依赖性PCa细胞系抗雄激素的疗效[58].其次,SFN通过阻碍IKK/IκB磷酸化和p65 NF-κB亚基核易位,阻断NF-κB信号传导,抑制AR表达[59].与SFN相似,在小鼠TRAMP C1 PCa细胞中,姜黄素(CUR)被认为是Keap1抑制剂,通过修饰Keap1 Cys-151的亲电性,降低Keap1表达,促进Nrf-2解离,并下调雄激素依赖性和雄激素非依赖性PCa细胞中AR基因的表达和活性[60,61]. ...
The nrf1 and nrf2 balance in oxidative stress regulation and androgen signaling in prostate cancer cells
1
2010
... Nrf-2是调节抗氧化反应元件的主要转录因子,通过调节血氧合酶1(HO-1)、NADPH-醌氧化还原酶1(NQO1)、谷胱甘肽S-转移酶A2(GSTA2)等抗氧化物酶,调节ROS水平[54].正常情况下,细胞质中Nrf-2与抑制蛋白Keap1结合,通过泛素蛋白酶体途径促进其降解.氧化应激导致NF-κB释放和核易位,并在转录水平直接抑制Nrf-2活性.通过使用能够激活Nrf-2的治疗剂,可以预防PCa转化为CRPC[55].在PCa中激活Nrf-2不仅能调节氧化应激水平,而且还可以通过诱导p120-Nrf1的核积累来降低AR的反式激活,以及抑制DHT诱导的AR活性[56].目前发现,甲基巴多索隆是一种强效的Nrf-2诱导剂,通过降低AR-FL和AR-V7抑制AR功能,提高耐恩杂鲁胺PCa细胞系(CWR22RV1)中恩杂鲁胺的疗效,可以作为PCa患者接受ADT时的辅助治疗[57].莱菔硫烷(SFN)在PCa中发挥作用的两个关键途径是Nrf-2激活和NF-κB抑制.首先,SFN与Keap-1相互作用,消除对Nrf-2的抑制作用,增加小鼠TRAMP C1 PCa细胞Nrf-2的表达,抑制AR转录以及降低PCa细胞中AR的稳定性[58];SFN也可以通过降解PCa细胞系中AR-FL和AR-V7,提高雄激素依赖性和雄激素非依赖性PCa细胞系抗雄激素的疗效[58].其次,SFN通过阻碍IKK/IκB磷酸化和p65 NF-κB亚基核易位,阻断NF-κB信号传导,抑制AR表达[59].与SFN相似,在小鼠TRAMP C1 PCa细胞中,姜黄素(CUR)被认为是Keap1抑制剂,通过修饰Keap1 Cys-151的亲电性,降低Keap1表达,促进Nrf-2解离,并下调雄激素依赖性和雄激素非依赖性PCa细胞中AR基因的表达和活性[60,61]. ...
Bardoxolone-methyl(CDDO-me)suppresses androgen receptor and its splice-variant AR-V7 and enhances efficacy of enzalutamide in prostate cancer cells
1
2020
... Nrf-2是调节抗氧化反应元件的主要转录因子,通过调节血氧合酶1(HO-1)、NADPH-醌氧化还原酶1(NQO1)、谷胱甘肽S-转移酶A2(GSTA2)等抗氧化物酶,调节ROS水平[54].正常情况下,细胞质中Nrf-2与抑制蛋白Keap1结合,通过泛素蛋白酶体途径促进其降解.氧化应激导致NF-κB释放和核易位,并在转录水平直接抑制Nrf-2活性.通过使用能够激活Nrf-2的治疗剂,可以预防PCa转化为CRPC[55].在PCa中激活Nrf-2不仅能调节氧化应激水平,而且还可以通过诱导p120-Nrf1的核积累来降低AR的反式激活,以及抑制DHT诱导的AR活性[56].目前发现,甲基巴多索隆是一种强效的Nrf-2诱导剂,通过降低AR-FL和AR-V7抑制AR功能,提高耐恩杂鲁胺PCa细胞系(CWR22RV1)中恩杂鲁胺的疗效,可以作为PCa患者接受ADT时的辅助治疗[57].莱菔硫烷(SFN)在PCa中发挥作用的两个关键途径是Nrf-2激活和NF-κB抑制.首先,SFN与Keap-1相互作用,消除对Nrf-2的抑制作用,增加小鼠TRAMP C1 PCa细胞Nrf-2的表达,抑制AR转录以及降低PCa细胞中AR的稳定性[58];SFN也可以通过降解PCa细胞系中AR-FL和AR-V7,提高雄激素依赖性和雄激素非依赖性PCa细胞系抗雄激素的疗效[58].其次,SFN通过阻碍IKK/IκB磷酸化和p65 NF-κB亚基核易位,阻断NF-κB信号传导,抑制AR表达[59].与SFN相似,在小鼠TRAMP C1 PCa细胞中,姜黄素(CUR)被认为是Keap1抑制剂,通过修饰Keap1 Cys-151的亲电性,降低Keap1表达,促进Nrf-2解离,并下调雄激素依赖性和雄激素非依赖性PCa细胞中AR基因的表达和活性[60,61]. ...
Multimodal actions of the phytochemical sulforaphane suppress both AR and AR-V7 in 22Rv1 cells:Advocating a potent pharmaceutical combination against castration-resistant prostate cancer
2
2017
... Nrf-2是调节抗氧化反应元件的主要转录因子,通过调节血氧合酶1(HO-1)、NADPH-醌氧化还原酶1(NQO1)、谷胱甘肽S-转移酶A2(GSTA2)等抗氧化物酶,调节ROS水平[54].正常情况下,细胞质中Nrf-2与抑制蛋白Keap1结合,通过泛素蛋白酶体途径促进其降解.氧化应激导致NF-κB释放和核易位,并在转录水平直接抑制Nrf-2活性.通过使用能够激活Nrf-2的治疗剂,可以预防PCa转化为CRPC[55].在PCa中激活Nrf-2不仅能调节氧化应激水平,而且还可以通过诱导p120-Nrf1的核积累来降低AR的反式激活,以及抑制DHT诱导的AR活性[56].目前发现,甲基巴多索隆是一种强效的Nrf-2诱导剂,通过降低AR-FL和AR-V7抑制AR功能,提高耐恩杂鲁胺PCa细胞系(CWR22RV1)中恩杂鲁胺的疗效,可以作为PCa患者接受ADT时的辅助治疗[57].莱菔硫烷(SFN)在PCa中发挥作用的两个关键途径是Nrf-2激活和NF-κB抑制.首先,SFN与Keap-1相互作用,消除对Nrf-2的抑制作用,增加小鼠TRAMP C1 PCa细胞Nrf-2的表达,抑制AR转录以及降低PCa细胞中AR的稳定性[58];SFN也可以通过降解PCa细胞系中AR-FL和AR-V7,提高雄激素依赖性和雄激素非依赖性PCa细胞系抗雄激素的疗效[58].其次,SFN通过阻碍IKK/IκB磷酸化和p65 NF-κB亚基核易位,阻断NF-κB信号传导,抑制AR表达[59].与SFN相似,在小鼠TRAMP C1 PCa细胞中,姜黄素(CUR)被认为是Keap1抑制剂,通过修饰Keap1 Cys-151的亲电性,降低Keap1表达,促进Nrf-2解离,并下调雄激素依赖性和雄激素非依赖性PCa细胞中AR基因的表达和活性[60,61]. ...
... [58].其次,SFN通过阻碍IKK/IκB磷酸化和p65 NF-κB亚基核易位,阻断NF-κB信号传导,抑制AR表达[59].与SFN相似,在小鼠TRAMP C1 PCa细胞中,姜黄素(CUR)被认为是Keap1抑制剂,通过修饰Keap1 Cys-151的亲电性,降低Keap1表达,促进Nrf-2解离,并下调雄激素依赖性和雄激素非依赖性PCa细胞中AR基因的表达和活性[60,61]. ...
Suppression of NF-kappaB and NF-kappaB-regulated gene expression by sulforaphane and PEITC through IkappaBalpha,IKK pathway in human prostate cancer PC-3 cells
1
2005
... Nrf-2是调节抗氧化反应元件的主要转录因子,通过调节血氧合酶1(HO-1)、NADPH-醌氧化还原酶1(NQO1)、谷胱甘肽S-转移酶A2(GSTA2)等抗氧化物酶,调节ROS水平[54].正常情况下,细胞质中Nrf-2与抑制蛋白Keap1结合,通过泛素蛋白酶体途径促进其降解.氧化应激导致NF-κB释放和核易位,并在转录水平直接抑制Nrf-2活性.通过使用能够激活Nrf-2的治疗剂,可以预防PCa转化为CRPC[55].在PCa中激活Nrf-2不仅能调节氧化应激水平,而且还可以通过诱导p120-Nrf1的核积累来降低AR的反式激活,以及抑制DHT诱导的AR活性[56].目前发现,甲基巴多索隆是一种强效的Nrf-2诱导剂,通过降低AR-FL和AR-V7抑制AR功能,提高耐恩杂鲁胺PCa细胞系(CWR22RV1)中恩杂鲁胺的疗效,可以作为PCa患者接受ADT时的辅助治疗[57].莱菔硫烷(SFN)在PCa中发挥作用的两个关键途径是Nrf-2激活和NF-κB抑制.首先,SFN与Keap-1相互作用,消除对Nrf-2的抑制作用,增加小鼠TRAMP C1 PCa细胞Nrf-2的表达,抑制AR转录以及降低PCa细胞中AR的稳定性[58];SFN也可以通过降解PCa细胞系中AR-FL和AR-V7,提高雄激素依赖性和雄激素非依赖性PCa细胞系抗雄激素的疗效[58].其次,SFN通过阻碍IKK/IκB磷酸化和p65 NF-κB亚基核易位,阻断NF-κB信号传导,抑制AR表达[59].与SFN相似,在小鼠TRAMP C1 PCa细胞中,姜黄素(CUR)被认为是Keap1抑制剂,通过修饰Keap1 Cys-151的亲电性,降低Keap1表达,促进Nrf-2解离,并下调雄激素依赖性和雄激素非依赖性PCa细胞中AR基因的表达和活性[60,61]. ...
Pyridine analogues of curcumin exhibit high activity for inhibiting CWR-22Rv1 human prostate cancer cell growth and androgen receptor activation
1
2016
... Nrf-2是调节抗氧化反应元件的主要转录因子,通过调节血氧合酶1(HO-1)、NADPH-醌氧化还原酶1(NQO1)、谷胱甘肽S-转移酶A2(GSTA2)等抗氧化物酶,调节ROS水平[54].正常情况下,细胞质中Nrf-2与抑制蛋白Keap1结合,通过泛素蛋白酶体途径促进其降解.氧化应激导致NF-κB释放和核易位,并在转录水平直接抑制Nrf-2活性.通过使用能够激活Nrf-2的治疗剂,可以预防PCa转化为CRPC[55].在PCa中激活Nrf-2不仅能调节氧化应激水平,而且还可以通过诱导p120-Nrf1的核积累来降低AR的反式激活,以及抑制DHT诱导的AR活性[56].目前发现,甲基巴多索隆是一种强效的Nrf-2诱导剂,通过降低AR-FL和AR-V7抑制AR功能,提高耐恩杂鲁胺PCa细胞系(CWR22RV1)中恩杂鲁胺的疗效,可以作为PCa患者接受ADT时的辅助治疗[57].莱菔硫烷(SFN)在PCa中发挥作用的两个关键途径是Nrf-2激活和NF-κB抑制.首先,SFN与Keap-1相互作用,消除对Nrf-2的抑制作用,增加小鼠TRAMP C1 PCa细胞Nrf-2的表达,抑制AR转录以及降低PCa细胞中AR的稳定性[58];SFN也可以通过降解PCa细胞系中AR-FL和AR-V7,提高雄激素依赖性和雄激素非依赖性PCa细胞系抗雄激素的疗效[58].其次,SFN通过阻碍IKK/IκB磷酸化和p65 NF-κB亚基核易位,阻断NF-κB信号传导,抑制AR表达[59].与SFN相似,在小鼠TRAMP C1 PCa细胞中,姜黄素(CUR)被认为是Keap1抑制剂,通过修饰Keap1 Cys-151的亲电性,降低Keap1表达,促进Nrf-2解离,并下调雄激素依赖性和雄激素非依赖性PCa细胞中AR基因的表达和活性[60,61]. ...
Curcumin induces stabilization of Nrf2 protein through Keap1 cysteine modification
1
2020
... Nrf-2是调节抗氧化反应元件的主要转录因子,通过调节血氧合酶1(HO-1)、NADPH-醌氧化还原酶1(NQO1)、谷胱甘肽S-转移酶A2(GSTA2)等抗氧化物酶,调节ROS水平[54].正常情况下,细胞质中Nrf-2与抑制蛋白Keap1结合,通过泛素蛋白酶体途径促进其降解.氧化应激导致NF-κB释放和核易位,并在转录水平直接抑制Nrf-2活性.通过使用能够激活Nrf-2的治疗剂,可以预防PCa转化为CRPC[55].在PCa中激活Nrf-2不仅能调节氧化应激水平,而且还可以通过诱导p120-Nrf1的核积累来降低AR的反式激活,以及抑制DHT诱导的AR活性[56].目前发现,甲基巴多索隆是一种强效的Nrf-2诱导剂,通过降低AR-FL和AR-V7抑制AR功能,提高耐恩杂鲁胺PCa细胞系(CWR22RV1)中恩杂鲁胺的疗效,可以作为PCa患者接受ADT时的辅助治疗[57].莱菔硫烷(SFN)在PCa中发挥作用的两个关键途径是Nrf-2激活和NF-κB抑制.首先,SFN与Keap-1相互作用,消除对Nrf-2的抑制作用,增加小鼠TRAMP C1 PCa细胞Nrf-2的表达,抑制AR转录以及降低PCa细胞中AR的稳定性[58];SFN也可以通过降解PCa细胞系中AR-FL和AR-V7,提高雄激素依赖性和雄激素非依赖性PCa细胞系抗雄激素的疗效[58].其次,SFN通过阻碍IKK/IκB磷酸化和p65 NF-κB亚基核易位,阻断NF-κB信号传导,抑制AR表达[59].与SFN相似,在小鼠TRAMP C1 PCa细胞中,姜黄素(CUR)被认为是Keap1抑制剂,通过修饰Keap1 Cys-151的亲电性,降低Keap1表达,促进Nrf-2解离,并下调雄激素依赖性和雄激素非依赖性PCa细胞中AR基因的表达和活性[60,61]. ...